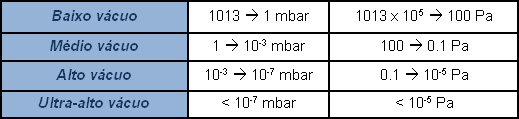PROPRIEDADES E LEIS DOS GASES Estas descrevem as relações entre as variáveis de estado, pressão (p), temperatura (T) e volume (V), de uma certa quantidade de gás (de massa m, de número de partículas N, de quantidade molar n). As leis são simples relações que foram encontradas experimentalmente e se referem porém ao <<gás perfeito>>. As moléculas de gás são consideradas puntiformes e entre elas não deve interagir nenhuma força e colidem em modo elástico entre si e com as paredes que delimitam o espaço.
O VÁCUO é conceitualmente a ausência total de matéria que, provavelmente, tem um maior significado filosófico (Horror Vacui). No ambiente técnico é reconhecido como VÁCUO o espaço onde a pressão é inferior àquela atmosférica. O VÁCUO ABSOLUTO é considerado como ausência de matéria em um espaço de volume, mas não é realizável. É melhor defini-lo como o melhor vazio que pode ser gerado em um espaço, porque não é possível remover complemente todos os gases (hidrogênio, oxigênio, nitrogênio, neônio e argônio são exemplos de gases permanentes). Muitas vezes também entende-se o vácuo como entidade física, e portanto em contraposição ao conceito de pressão. Na realidade, a pressão é a única entidade de medida, tanto pelos valores mais elevados da pressão atmosférica, quanto por aqueles inferiores a ela.
Definimos PRESSÃO o resultado de uma força que age perpendicularmente sobre a unidade de superfície. Os gases são constituídos por um grande número de partículas, que estão constantemente em movimento. Quando estas colidem sobre uma superfície, essas colisões geram um impulso, mensurável como força. A pressão é a soma de todas as forças produzidas por partículas na unidade de superfície. As partículas que compõem os gases, quando se encontram em equilíbrio termodinâmico, distribuem-se uniformemente no espaço, de modo que a pressão e a composição do gás é uniforme em todos os pontos do recipiente.
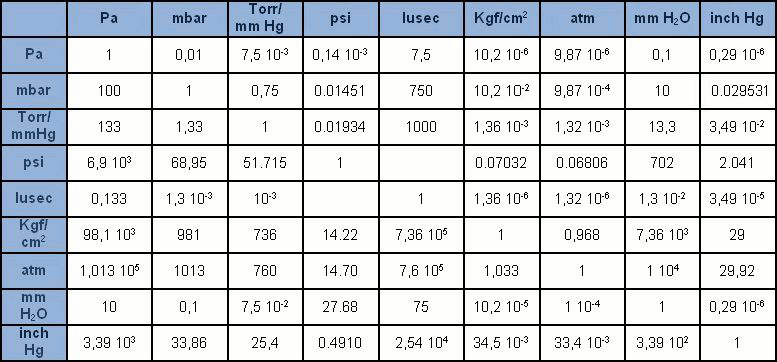
A unidade de medida no Sistema Internacional (SI) é o pascal [Pa], que considera a pressão resultante da força de um newton [N] em uma superfície de um metro quadrado [m2]. Porém, o pascal é uma unidade de grandeza um pouco pequena em comparação com as unidades a que estávamos acostumados anteriormente. Portanto, geralmente é expresso com os seus múltiplos: hPa = 100Pa (1 mbar), kPa = 1.000Pa (0,1 bar), MPa = 1 milhão de Pa (10 bar). Tolerado o uso do bar e do mbar, o Pa e seus múltiplos estão lentamente substituindo as muitas outras unidades de medida de pressão que no passado eram amplamente difundidas (mmHg, mmH2O, Torr, atm, psi). A tabela contém todas as mais comuns unidades de medida de pressão com os correspondentes fatores de conversão.
A pressão atmosférica é de cerca de um bar absoluto (1013 mbar), um manômetro que indica zero na pressão atmosférica e, ao contrário, mostra um sinal negativo em vácuo, mede a pressão relativa como diferença em relação à pressão atmosférica. Na realidade, não há pressão negativa. Em alguns casos, indica-se em percentual o valor de vácuo produzido, considerando 100% o vácuo absoluto; não é suficientemente representativo e a extensão do campo de aplicação torna a indicação subjetiva. É mais correto expressar o valor de pressão, o vácuo, indicando o seu valor absoluto. Visto que um valor zero de pressão é praticamente inatingível, a indicação do valor de vácuo será um decimal com tantos zeros após a vírgula quanto for baixo o valor de pressão, ou seja “alto” o valor de “vácuo”. Por praticidade, usam-se expressões logarítmicas em vez de escrever uma infinidade de zeros antes de um número significativo. Então, para evitar interpretações subjetivas, o campo das pressões inferiores àquela atmosférica, definido vácuo, é subdividido com várias indicações sobre o nível.