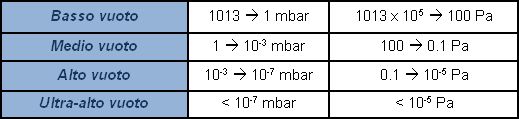Nel caso in cui si desideri confrontare il flusso equivalente generato da una perdita espressa in un gas diverso da quello misurato, è necessario operare una conversione. È necessario però conoscere o determinare a priori il regime di flusso da considerare nella trasformazione. Nel flusso laminare a causa del coinvolgimento dell’insieme della molecole, si osserva una netta dipendenza dalla viscosità dinamica del gas impiegato. Noto il valore di flusso generato da una perdita, si può calcolare l’equivalente in un altro gas (nota la sua viscosità dinamica) attraverso la formula dedotta qui di seguito:
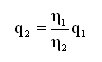
Questa formula si applica nel caso in cui siamo in condizioni di flusso laminare.
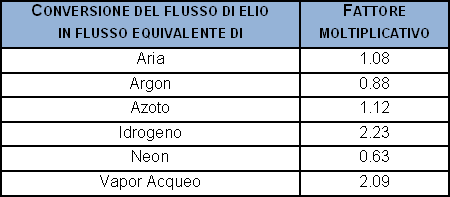
Per convertire un flusso in elio in flusso di alcuni gas, in regime laminare:
Nel flusso molecolare le molecole si muovono in modo indipendente le une dalle altre; quindi, invece del moto di insieme del gas, occorre considerare il moto delle singole molecole.
Si ricava così la seguente espressione dipendente dalla massa molare dei gas impiegati:
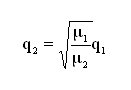
Per convertire un flusso in elio in flusso di alcuni gas, in regime molecolare:
Per valori di leakrate superiori a 10-2 mbarL/s, si può ancora definire un regime di flusso turbolento. Tale flusso è caratteristico di grandi perdite ed elevate differenze di pressione. Il semplice calcolo che considera una conduttanza geometrica definita, indica secondo la bibliografia, che flussi inferiori a 10-6 , talvolta inferiori a 10-7 mbar·L/s sono da intendersi molecolari, mentre flussi superiori a 10-4 mbar·L/s sono da intendersi laminari. Le fughe reali però non sono mai in pratica caratterizzate da un singolo e geometricamente definito canale di perdita. In laboratorio è stato sperimentato che perdite aventi flussi inferiori a 10-4 mbar·L/s (talvolta già da 10-3 mbar·L/s) si comportano secondo le leggi che governano il flusso molecolare anziché il flusso viscoso. Questo perché il flusso di perdita è prodotto da una somma di canali (fessurazioni) in parallelo tra loro all’interno dei quali il flusso è decisamente inferiore, e sicuramente molecolare. Ancora utile considerare una importante proprietà dei gas: la diffusione di un gas in un altro gas. A parità di condizioni, i gas più leggeri diffondono più velocemente di gas pesanti. La diffusione dei gas è inversamente proporzionale alla loro massa molecolare relativa, secondo la legge di Graham.
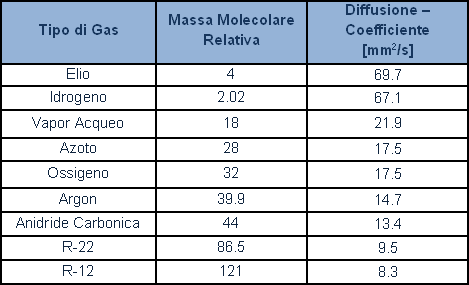
Si riportano alcuni valori di diffusione dei gas più importanti e dei refrigeranti:
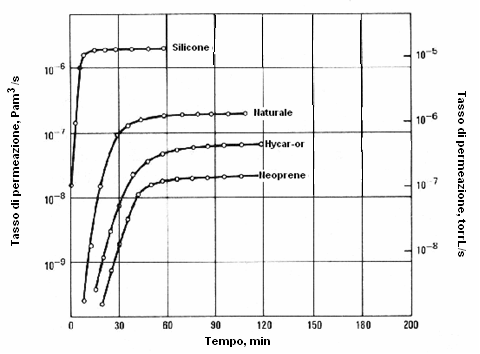
Altra proprietà è la permeazione intesa come il passaggio di un fluido, all'interno e fuori di una barriera solida che non presenta fori. Il processo prevede la diffusione attraverso un solido e può coinvolgere molti fenomeni come l'adsorbimento, la dissociazione, la migrazione e desorbimento. La permeazione può avere un effetto negativo sulla ricerca delle perdite con elio quando le perdite sono piccole e il tempo di prova lungo. Un materiale che necessita di particolare attenzione è il teflon utilizzato nelle guarnizioni. L’elio ha una alta permeabilità attraverso il teflon. Nel grafico sotto riportato ci sono diverse curve che mostrano tasso di permeazione dell’elio a diverse pressioni attraverso guarnizioni di gomma.
Lo spessore considerato è di 4mm con 4mm di sezione trasversale per 25mm di lunghezza a 25°C in Pam3/s.
Si può definire perdita o fuga una fessurazione in un sistema che si vuole ermetico ed attraverso la quale sfugga del gas. Dimensionalmente una perdita è quantificata mediante l’indicazione della quantità di gas in volume che sfugge con un determinato ΔP ai capi della perdita in un secondo. Attraverso una canalizzazione si verifica un flusso di gas se tra i suoi estremi è mantenuta una differenza di pressione. La capacità di una canalizzazione a lasciare passare il flusso di gas è legata oltre che alla differenza di pressione tra i due estremi della canalizzazione anche alle sue caratteristiche geometriche; per questo viene introdotta una grandezza (conduttanza) definita come rapporto tra il flusso di gas e la differenza di pressione tra le estremità della canalizzazione C = Q / (p1 - p2) espressa in m3/s o in l/s.
- L’equazione dei gas ideali è espressa attraverso la seguente formula:
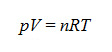
dove n è il numero di moli di gas contenuto nel volume V a pressione p e temperatura assoluta (in gradi Kelvin [K]) ed R è la costante dei gas (pari a 8,31441 J·mol-1·K-1). Si ricava, in questo modo, nel caso in cui la pressione sia una costante del sistema l’equazione in modo in cui si fa dipendere il flusso dalla variazione di volume di gas, dalla pressione e dal tempo:
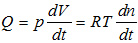
L’unità di misura per il leakrate (Q) nel Sistema Internazionale (SI) è il Pa·m3/s. Il mbar·L/s è una unità di misura del flusso tollerata dal SI in quanto ad essa legata per multipli.
1 mbar·l/s = 10-1 Pa·m3/s (1 Pa = 10-2 mbar e 1 m3 = 103 litri).
Nel caso dei mbar·l/s, il tasso di fuga vale Q = 1 mbar·l·s-1 se in una camera chiusa ed evacuata, di volume 1 litro, la pressione aumenta, in 1 secondo, di 1 mbar, o, nel caso della sovrapressione nella camera, essa diminuisce di 1 mbar.
Non sempre però si ha la possibilità di avere il valore di perdita espresso nelle unità di misura del sistema internazionale; conviene allora convertire tali valori in Pa·m3/s o in mbar·l/s.
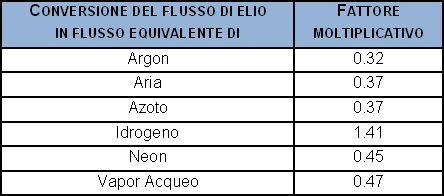
Un caso specifico, ad esempio nel settore dei refrigeranti, i valori di fuga sono espressi come g/anno di refrigerante perso. Il flusso massivo in questo caso è trasformato in g/mole e quindi moli/s, ed infine in flusso gassoso. Di seguito viene fornita una tabella nella quale viene applicata la conversione da flusso massivo a flusso equivalente, e si riportano le conversione dei g/anno dei più noti refrigeranti ed altri gas negli equivalenti flussi nominali d’elio in mbar·l/s.
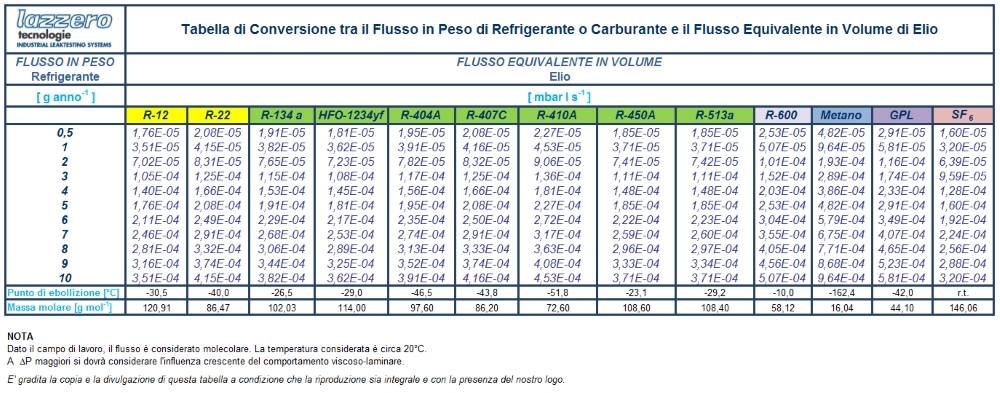
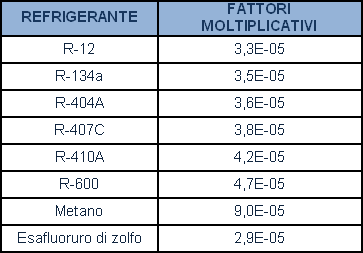
La trasformazione dal flusso in peso (g/anno) a flusso di elio equivalente (mbar·l/s) può essere semplicemente realizzata moltiplicando i g/anno per i seguenti coefficienti:
- La Legge di Boyle-Mariotte afferma che quando il volume di un gas diminuisce (ad esempio, sotto l’azione di un pistone), la pressione aumenta della stessa quantità, se la temperatura non cambia. Quindi il prodotto tra pressione e volume è uguale ad una costante: pV=cost e T=cost.
- La Legge di Charles afferma che, se la pressione è mantenuta costante, il volume del gas aumenta con il crescere della temperatura: V=V0 (1+atT) e p=cost.
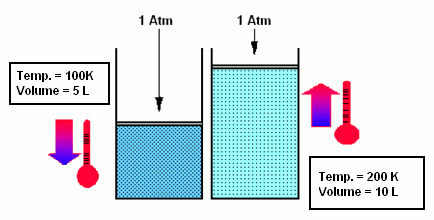
- La Legge di Gay-Lussac afferma che, se il volume rimane costante, la pressione aumenta all’aumentare della temperatura secondo una relazione lineare. Il rapporto tra la variazione della pressione e quella della temperatura è uguale ad una costante: p=p0 (1+btT) e V=cost.
È la condizione che si instaura attraverso una condotta o un capillare (fuga o perdita). Nella tecnologia del vuoto si possono distinguere tre differenti regimi di flusso:
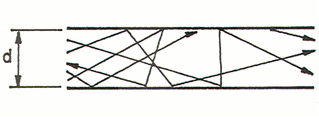
- il regime viscoso o laminare: riscontrabile da pressione atmosferica, le molecole, numerose, si muovono in modo quasi compatto dando un flusso ed un senso alla corrente; predominano quindi gli effetti fisici dovuti alla densità del gas come la viscosità dinamica. La direzione preferenziale di tutte le molecole del gas è la stessa della direzione macroscopica della corrente di gas, come si può osservare nella figura sottostante. Il flusso è governato dalle forze viscose ed è costante nel tempo;

La legge che descrive il flusso viscoso attraverso una sezione tubolare dalla sezione circolare è quella di Poisseuille:
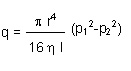
- dove con r si indica il raggio del tubo, con l la lunghezza, con ? la viscosità dinamica del gas e con p le diverse pressioni.
Si riporta una tabella con le viscosità dinamica dei principali gas e refrigeranti:
il regime molecolare si riscontra dove la densità delle molecole è minore, cioè in condizioni di vuoto spinto e, in termini di libero cammino medio, le probabilità di urto tra molecola e molecola sono inferiori alle probabilità di urto molecola-parete. Predominano invece le collisioni delle particelle contro le pareti. Come risultato delle riflessioni elastiche e del desorbimento una particella di gas assume una direzione casuale e quindi non si ha uno scorrimento macroscopico. Il moto del fluido avviene in maniera caotica, senza seguire traiettorie ordinate come nel caso di regime laminare.
La formula che governa il regime molecolare è la seguente:
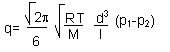
dove con R si indica la costante dei gas perfetti, con T la temperatura assoluta, con M la massa relativa, con d il diametro della tubatura, con l la lunghezza e con p le pressioni.
- il regime (transitorio) di Knudsen è di difficile definizione in quanto risulta problematico anche definire a quali leggi sottostanno i gas nel passaggio da un flusso viscoso ad uno molecolare, o viceversa.
Si può fornire una formula come somma dei contributi degli altri due regimi.
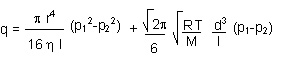
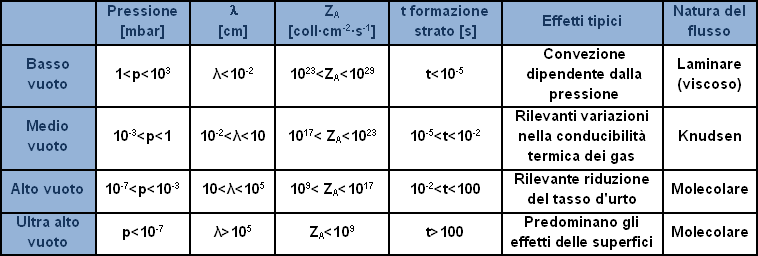
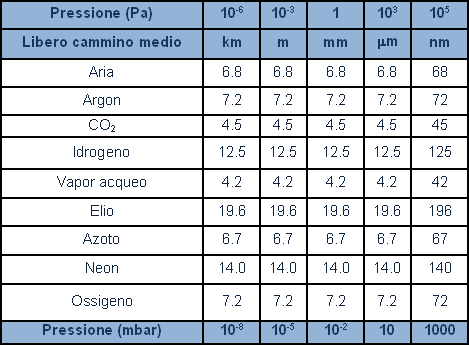
La tabella suddivide le regioni del vuoto con riferimento alla pressione indicando le caratteristiche e gli effetti tipici. Con il simbolo ? (lambda) si intende "il libero cammino medio", cioè la lunghezza media del percorso compiuto da una molecola tra un urto e quello successivo; ZA il numero di collisioni della molecola su una superficie nell’unità di tempo ed infine t formazione strato il tempo necessario per coprire con uno strato di gas dello spessore di una molecola una superficie pulita in vuoto.
Riportiamo una tabella in cui si mettono in relazione il libero cammino medio di differenti gas a diverse pressioni.
PROPRIETA’ e LEGGI DEI GAS Queste descrivono le relazioni tra le variabili di stato, pressione (p), temperatura (T) e volume (V), di una determinata quantità di gas (di massa m, di numero di particelle N, di quantità molare n). Le leggi sono semplici relazioni che sono state trovate per via sperimentale e si riferiscono però al <<gas perfetto>>. Le molecole del gas vengono considerate puntiformi e tra loro non deve interagire alcuna forza e si scontrano in modo elastico tra loro e con le pareti che delimitano lo spazio.
Il VUOTO è concettualmente l’assenza totale di materia (Horror Vacui) che ha probabilmente un maggiore significato filosofico. In ambiente tecnico si riconosce con VUOTO lo spazio nel quale la pressione è inferiore a quella atmosferica. Il VUOTO ASSOLUTO è considerato come assenza di materia in uno spazio di volume, ma non è realizzabile. Meglio definirlo come il miglior vuoto che si può generare all’intero di uno spazio, poiché non è possibile eliminare completamente tutti i gas (idrogeno, ossigeno, azoto, neon e argon sono esempi di gas permanenti). Spesso inoltre capita di sentire intendere il vuoto come entità fisica, e da qui, in contrapposizione al concetto di pressione. In realtà la pressione è l’unica entità di misura, sia per i valori maggiori della pressione atmosferica, sia per quelli inferiori ad essa.
Definiamo PRESSIONE il risultato di una forza che agisce perpendicolarmente sull’unità di superficie. I gas sono costituiti da un gran numero di particelle, che sono continuamene in movimento. Quando queste collidono su una superficie, tali collisioni generano una spinta, misurabile come forza. La pressione è la somma di tutte le forze prodotte dalle particelle sull’unità di superficie. Le particelle che compongono i gas, quando si trovano nell’equilibrio termodinamico, si distribuiscono uniformemente nello spazio, così la pressione e la composizione del gas è uniforme in ogni punto del contenitore.
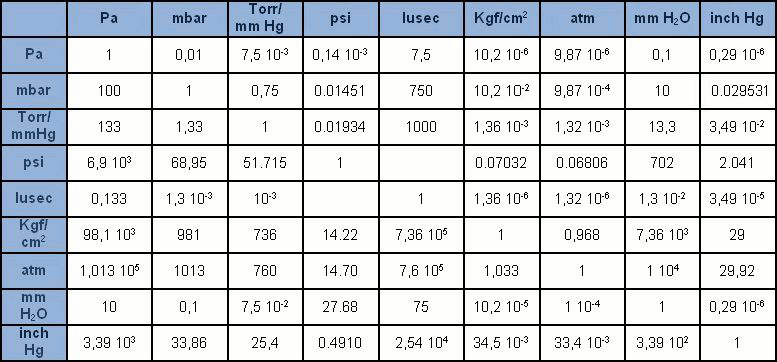
L’unità di misura nel Sistema Internazionale (SI) è il pascal [Pa], che considera la pressione risultante dalla forza di un newton [N] su una superficie di un metro quadrato [m2]. Il pascal è tuttavia una unità di grandezza un po’ piccola a confronto con le unità a cui eravamo precedentemente abituati. Viene quindi espresso generalmente con i suoi multipli: hPa = 100Pa (1 mbar), kPa = 1.000Pa (0,1 bar), MPa = 1 milione di Pa (10 bar). Tollerato l’uso del bar e del mbar, il Pa e i suoi multipli stanno lentamente sostituendo le numerose altre unità di misura della pressione che nel passato erano largamente diffuse (mmHg, mmH2O, Torr, atm, psi). In Tabella sono presentate tutte le più ricorrenti unità di misura della pressione con i corrispondenti fattori di conversione.
La pressione atmosferica vale circa un bar assoluto (1013 mbar), un manometro che segna zero alla pressione atmosferica e mostra invece un segnale negativo in vuoto, misura la pressione relativa quale scostamento rispetto alla pressione atmosferica. In realtà non esistono pressioni negative. In alcuni casi si indica in percentuale il valore di vuoto prodotto, considerando 100% il vuoto assoluto; non è sufficientemente rappresentativo e l’estensione del campo di applicazione rende l’indicazione soggettiva. È più corretto esprimere il valore di pressione, o vuoto, indicandone il valore assoluto. Visto che un valore zero di pressione è praticamente irraggiungibile, l’indicazione del valore di vuoto sarà un decimale con tanti zero dopo la virgola quanto è basso il valore di pressione cioè “alto” il valore di vuoto. Per praticità si utilizzano espressioni logaritmiche anziché la scrittura di una infinità di zero prima di un numero significativo. Per evitare poi interpretazioni soggettive, il campo delle pressioni inferiori a quella atmosferica, definito vuoto, viene suddiviso con diverse indicazioni sul livello.